碳-碳键是构成有机化合物基本骨架的化学键,碳-碳键的断裂反应在生命体系和工业生产中普遍存在。发展碳-碳键断裂的新方法具有十分重要的意义,不仅可以为现代合成化学的应用提供大量自然界中廉价易得的原材料,还能为缓解能源危机、减少环境污染和可再生资源的利用提供新的解决方案,如石油工业产品的改性利用、造成白色污染的塑料制品降解以及高聚物降解再转化利用等。尽管如此,与已广泛研究、日趋成熟的碳-碳键形成的方法相比,碳-碳键断裂的方法学研究仍相对滞后。
相比于基于官能团化学(如C-X键转化)和非官能团化学(如C-H键转化)目标分子的合成方法,过渡金属催化环状分子的碳-碳键断裂重组策略几乎无可替代,它可以最大限度地改变目标分子的骨架结构,在构建全新开链分子的同时对两个末端碳原子进行官能化。目前,这一策略已广泛用于C=C键的开环复分解及臭氧化(图1A)。相比之下,C-C单键的开环断裂重组具有较大的局限性,一般只发生于具有较大张力的三、四元环分子。尽管近年来一些报道发现,非张力的五、六元环底物也能实现这一类型的反应,但主要涉及环酮、环酮亚胺类化合物,且发生断裂的碳-碳键类型多为环上相对活泼的C(sp2)-C(sp2/sp3)键。如何通过切断相对惰性的C(sp3)-C(sp3)键来打开非张力的简单环状分子(如环状胺、环状醚、环状酮)并重组仍旧具有相当的难度和挑战性(图1B)。
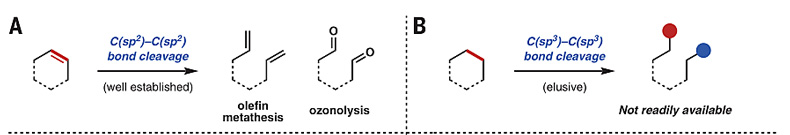
图1. 环状分子碳-碳键断裂重组策略重建分子骨架。图片来源:Science
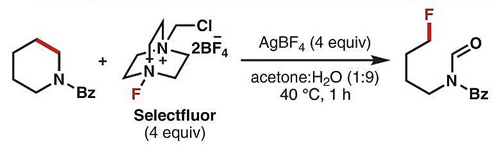
近日,美国加州大学伯克利分校(UC Berkeley)的Richmond Sarpong教授(点击查看介绍)课题组开创了一种切断非张力环状胺分子C(sp3)-C(sp3)键的新方法。该研究使用银盐作为促进剂,Selectflour为氧化剂和氟化试剂,通过单电子转移机理将环状胺α-碳氧化并生成烷氧自由基C-C-O•,随后烷氧自由基驱动的β-断裂可选择性地实现环上惰性C(sp3)-C(sp3)键断裂,进而产生末端碳甲酰化的烷基自由基,并被氟源捕获。该方法可以实现一系列饱和四至八元氮杂环化合物的碳-碳键断裂,生成末端醛基和F原子取代的脂肪链分子,并可用于肽的后期修饰,相关成果发表在Science上。
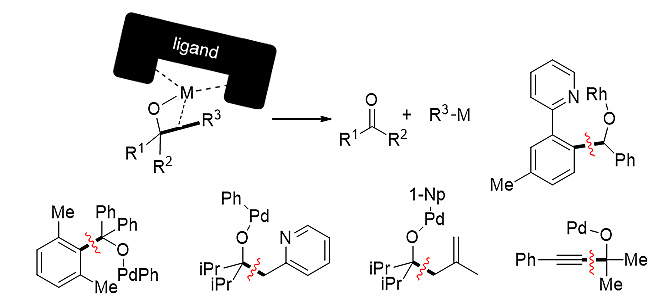
烷氧自由基驱动的β-断裂(β-Scission/β-fragmentation)和烷氧金属驱动的β-碳消除(β-carbon elimination)是实现醇类化合物β位C-C键断裂与重组最常用的方法,也是C-C键活化的两大基元反应。β-断裂将醇分子切割为羰基与碳自由基,β-碳消除则将醇分子切割为羰基与碳金属物种。虽然二者都可适用于张力环醇类底物,但是在非张力醇分子体系下却有着明显的不同。

在β-碳消除的策略中,为了避免烷氧基金属的β-H消除,底物选择上更多是三级醇或是有导向基团的二级醇;此外,在碳-碳键断裂的过程中,金属需要与C-C的σ键发生作用;在能量上,C-C的σ成键轨道和σ*反键轨道都难以与金属的空轨道、填充轨道匹配(除了张力C-C的σ键),这时就需要借助配体和附近π轨道基团。因此,β-消除策略倾向于切断醇分子中相对富电性的芳基碳、烯丙基碳、苄基碳、炔基碳等,同时也可以生成无β-H、相对稳定的碳-金属物种R-M(图3)。
相比之下,β-断裂可以与β-碳消除形成较好的互补,该过程不涉及β-氢消除的问题,烷氧自由基中氧原子的半填充轨道也可以较好地与C-C的σ键发生作用,适用于切断相对惰性的C(sp3)-C(sp3)键,并形成相对稳定的烷基自由基R•,继而发生加成或取代反应。例如,Beckwith曾报道了二级环戊氧自由基在室温下发生β-断裂开环反应,形成烷基自由基(J. Am. Chem. Soc.,1989,111, 230)(图4)。目前,在β-断裂的策略中,人们可以通过过渡金属催化(主要为Ag催化)或光诱导等方法促进醇分子产生烷氧自由基,从而诱导碳-碳键断裂重组。
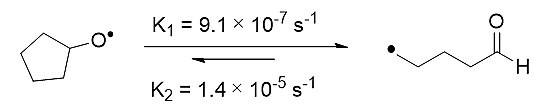
基于此,作者设想使用Ag盐(Ag2+/Ag+标准还原电势为+1.98 V vs SCE)将环胺分子氧化为环状亚铵阳离子A(阳极峰电位为+1.13 V vs SCE),随后在H2O的亲核进攻下生成α-碳羟基取代的半胺醛B,B进一步在Ag盐作用下形成烷氧自由基并诱导β-断裂发生开环,生成末端碳甲酰化的烷基自由基C,C最终被亲电氟化试剂捕获得到甲酰化-氟化产物(图5)。
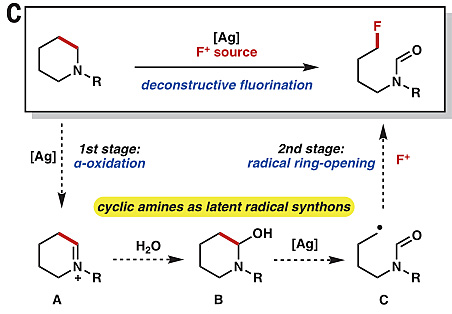
图5. Ag盐促进饱和环胺分子碳-碳键断裂重组的设想。图片来源:Science
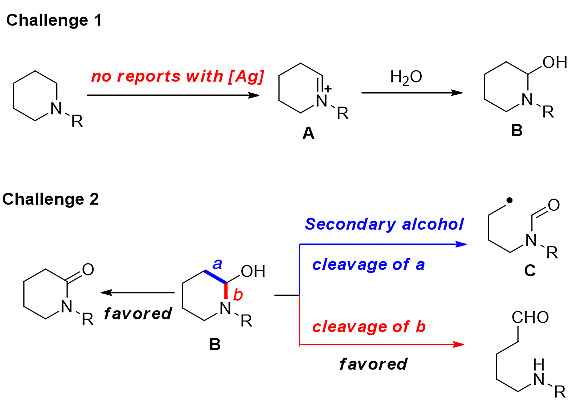
虽然这一串联反应策略看似很简单,但要实现这一过程仍然具有相当的难度。一方面,环胺分子生成环亚铵阳离子A的过程中还未曾有使用Ag催化体系的报道,并且Ag催化醇分子的β-断裂重组策略中多使用三级醇底物,二级醇底物鲜有报道;另一方面,半胺醛B更容易发生C-N键断裂开环或过度氧化得到环状酰胺(图6)。
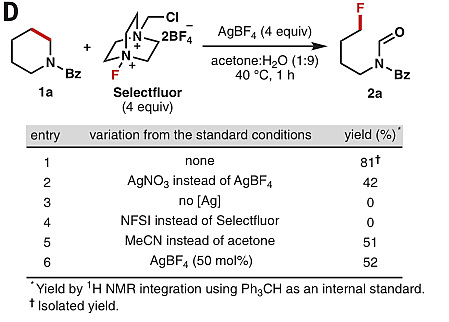
经过大量的反应条件筛选,作者发现在4当量AgBF4和Selectflour的作用下,哌啶1a在丙酮-水(1:9)的混合溶剂中、40 ℃的条件下反应1 h即能发生碳-碳键断裂开环反应,以81%的产率生成甲酰化-氟化产物2a。
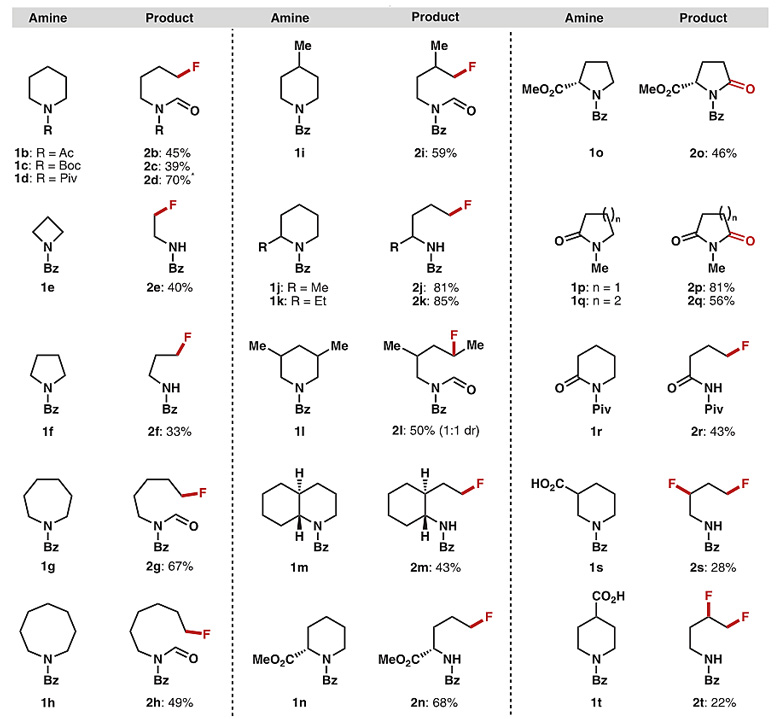
在最佳条件下,作者对底物的适用范围进行了考察。哌啶N上的取代基可以是Bz、Ac、Boc、Piv(1a-1d),氮杂环大小可以是四元到八元环(1e-1h),哌啶环上可以兼容烷基和酯基,当环上存在羧基时,反应可通过自由基脱羧引入第二个F原子(1s、1t)。对于N-Bz哌啶酮1r,反应生成氟化产物,而N-Me哌啶酮或吡咯酮1p、1q及脯氨酸酯1o则生成过度氧化的产物。值得一提的是,部分底物在反应后生成了去甲酰化-氟化产物。此外,该方法还可对肽分子中的含氮杂环进行后期修饰。
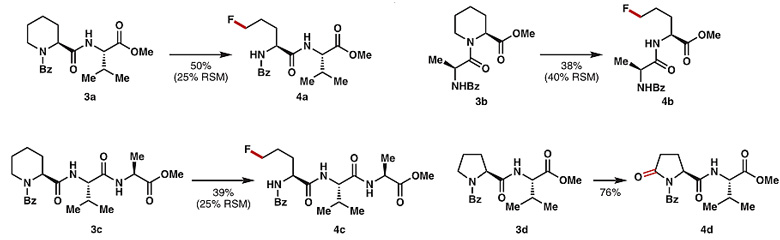
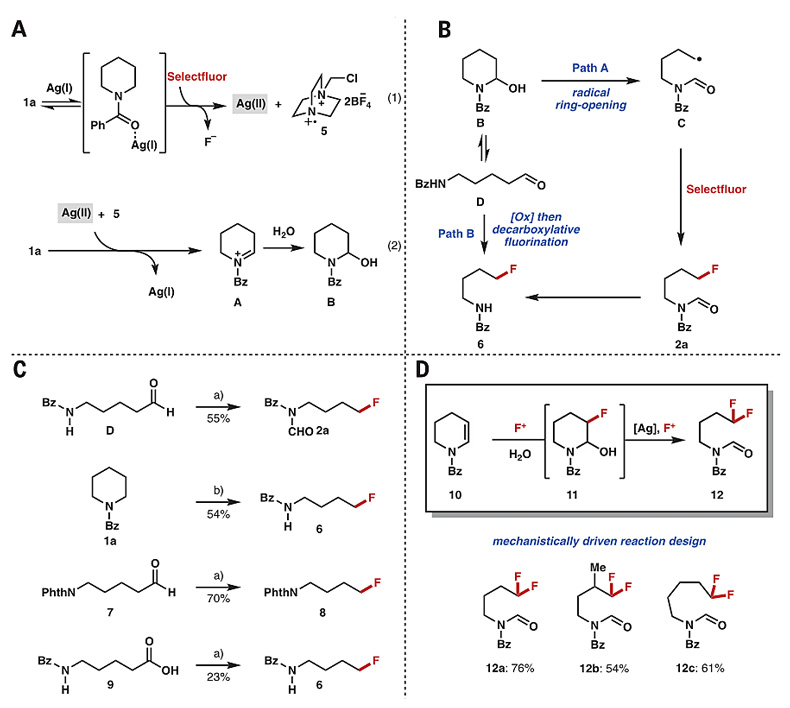
作者提出了可能的反应机理:Selectflour将Ag(I)氧化为Ag(II),同时生成自由基阳离子5,随后环胺1a在Ag(II)和5的作用下生成环状亚铵阳离子A,并被H2O捕获形成半胺醛B,该过程中5负责攫取胺α-碳上的H原子,Ag(II)则通过单电子转移过程捕获N原子上的电子(图10A)。作者认为半胺醛B生成甲酰化-氟化产物2a的过程主要经历烷氧自由基诱导的C-C键断裂开环反应(Path A),而2a也可能进一步消除甲酰基得到6。当然,半胺醛B生成去甲酰基-氟化产物6的过程也有可能经过Path B途径,即B先发生C-N键断裂开环得到醛D,D进一步氧化为羧酸后发生脱羧氟化(图10B)。
他们使用C-N键开环产物醛D在标准条件下进行反应,生成了Path A途径的产物2a(55%),表明半胺醛B的C-N键开环是一个可逆过程。随着反应时间的延长,环胺1a经Path A途径生成2a后可进一步转化为去甲酰化产物6(54%)。虽然使用无法发生C-N键环化的醛7时,反应可通过Path B途径先氧化后脱羧形成去甲酰化-氟化产物8(70%);但是使用羧酸9时脱羧反应仅以23%的产率生成去甲酰化-氟化产物6。这些结果表明,反应中两种产物大部分可能主要通过碳-碳键断裂开环机理,即Path A途径生成(图10C)。此外,环状烯酰胺10在25 mol%的Ag盐催化下,可通过C=C键的亲电氟化形成β-氟代中间体11,11再进一步发生碳-碳键断裂开环生成末端碳偕二氟取代的产物12(图10D)。
在谈到这项工作的意义时,Richmond Sarpong教授说道,“大多数复杂化合物的后期官能化都采用C-H键转化的策略,但这只能对分子中的边边角角进行修饰”,他还补充道,“如果想要获得更大的改变,你需要考虑分子核心上的C-C键。”随心所欲地切断分子中的碳-碳键,可以获得更丰富多样的分子,这种对化学空间的自由探索有助于发现新的药物分子。[1]
英国格拉斯哥大学的Joëlle Prunet教授对这项工作赞赏不已,“反应简洁有用,这正是我喜欢的(有机合成)方法学,显然,这是一个很有想法的工作。”当然,这项新的研究也并非完美无瑕,使用过量的Ag盐和Selectflour可能会让这一方法的实用性大打折扣。对此,Joëlle Prunet教授表示,“4当量的Ag盐有时可能要比10 mol%的Pd催化剂更便宜……我相信这个缺点最终会解决,产率也会提高。”[1]AG真人 AG平台AG真人 AG平台AG平台真人 真人AG 平台官网AG平台真人 真人AG 平台官网AG平台真人 真人AG 平台官网