高二的同学们在这个学期将要学习到选修四的知识,选修四第一章节主要讲了化学的能量变化,今天化学姐就给大家讲一讲有关反应热与焓变这两个知识点。
(3)化学反应中的能量转化形式:热能、光能、电能等。通常主要表现为热量的变化。
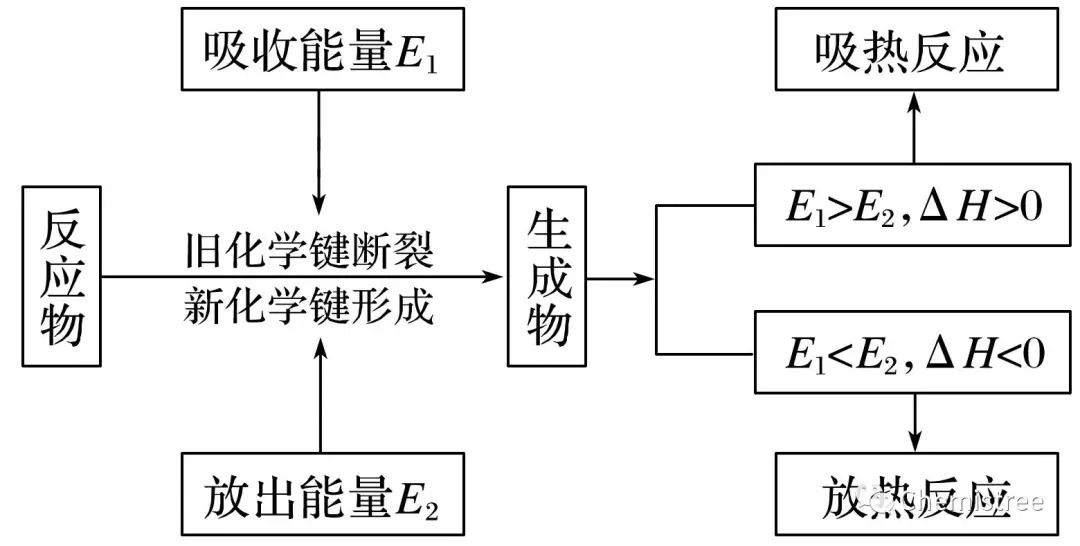
① 破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高。AG平台真人 真人AG 平台官网
② 形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低。
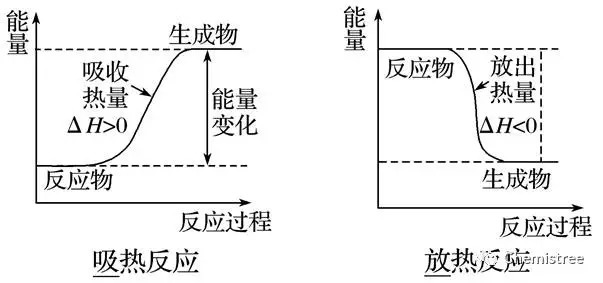
放热反应:①可燃物的燃烧②酸碱中和反应;③大多数化合反应;④金属与水或酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应等。
吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
①概念:在101 kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→CO2(g),H→H2O(l),S→SO2(g)等。
②在书写热化学方程式时,应以燃烧 1 mol 物质为标准来配平其余物质的化学计量数。
①概念:在稀溶液中,强酸跟强碱发生中和反应生成1mol液态H2O时的反应热叫中和热。
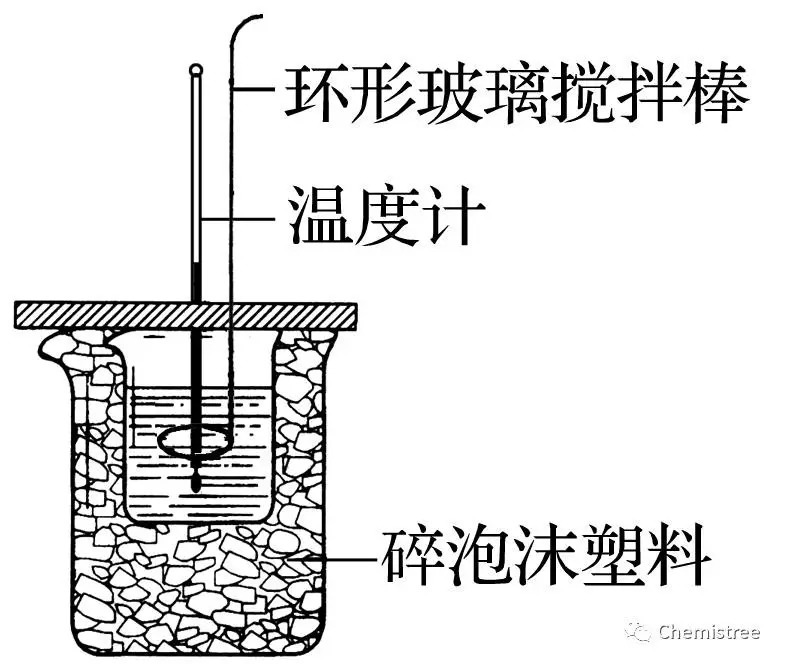
A.碎泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。
C.因为弱酸或弱碱存在电离平衡,电离过程需要吸热,实验中若使用弱酸、AG平台真人 真人AG 平台官网弱碱则测得的反应热数值偏小。
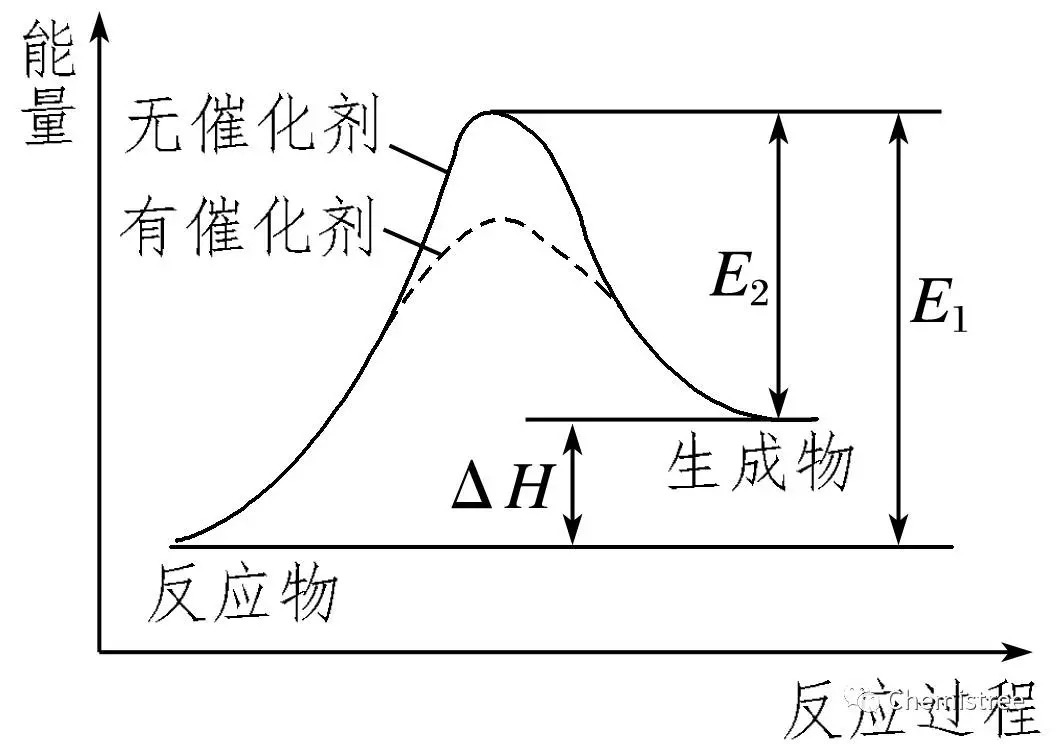
(2)在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即E1=E2+ΔH。
(1)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH表示,其后所跟数值都需要带“+”、“-”符号。如:某反应的反应热(或焓变)为ΔH=-QkJ·mol-1或ΔH=+QkJ·mol-1。
(2)由于中和反应和燃烧均是放热反应,表示中和热和燃烧热时可不带“-”号。如:某物质的燃烧热为ΔH=-Q kJ·mol-1或Q kJ·mol-1。AG真人 AG平台AG真人 AG平台AG真人 AG平台