AG真人 AG平台AG真人 AG平台AG真人 AG平台今天我们来介绍焓变及热化学方程式,这在我们中学化学中,也是要常考的一个,焓变即物体焓的变化量。通过我们的努力学习,可以轻松掌握。
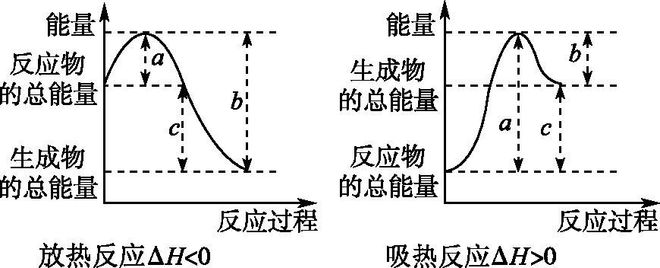
①焓变:生成物与反应物的焓值差,焓变定义式 ΔH=H(生成物)-H(反应物),单位KJ /mol
恒压条件下,它等于反应前后体系的焓变,用符号ΔH表示,单位为kJ/mol或kJ·mol-1
④活化能:活化分子具有的最低能量与分子的平均能量之差,即非活化分子转变为活化分子所须吸收的能量。
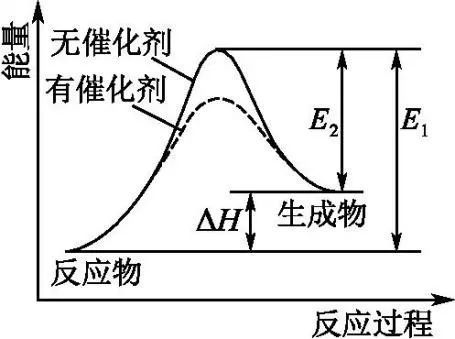
b.b表示生成新化学键放出的能量,也可以表示活化分子结合成生成物分子所放出的能量。
①化学反应的本质是旧化学键的断裂和新化学键的形成,任何化学反应都具有热效应。旧化 学键的断裂和新化学键的形成是同时进行的,缺少任何一个过程都不是化学变化。
②吸热反应的发生不一定需要加热,放热反应的发生可能需要加热,也可能不需要加热。
③同温同压下,反应的△H与反应条件无关,如H2(g) + CL2(g)=2HCl(g)在光照和点燃条件下的△H相同。
第二步——用g、l、s、aq(分别表示气体、液体、固体、溶液)表示物质聚集状态。
第四步——在方程式后书写△H,△H应包括“+”或“-”、数字和单位(kJ/mol)
①热化学方程式不标“↑”“↓”,但必须用s、l、g、aq等标出物质的聚集状态。
②热化学方程式的化学计量数只表示物质的量,可以是整数,也可以是分数。当化学计量数翻倍时,ΔH也翻倍。其ΔH必须与化学方程式AG平台真人 真人AG 平台官网及物质的聚集状态相对应。
③ΔH应包括“+”或“-”在方程式后面注明热量变化,吸热反应ΔH 0;放热反应ΔH 0。数值和单位为(kJ·AG平台真人 真人AG 平台官网mol-1)。
④可逆反应ΔH的数值表示完全反应时的反应热,正、逆反应的ΔH的数值相等、符号相反。
⑤ΔH是一定温度和压强下的反应热,在 25 ℃、101 kPa下测定的ΔH可不注明温度和压强。
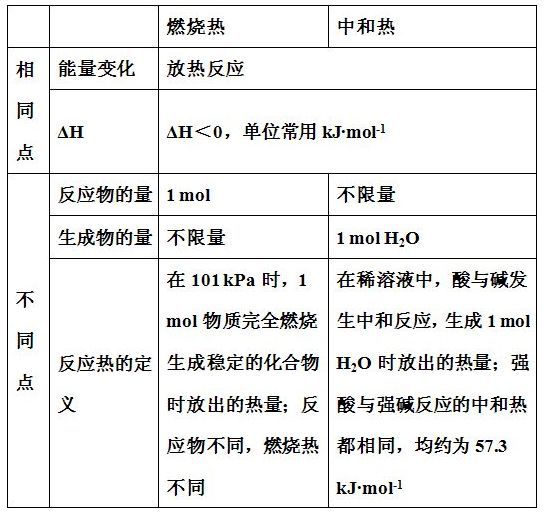
☆燃烧热热化学方程式的可燃物的化学计量数为1,生成产物为稳定氧化物,水为液态。
①实验步骤a.用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
b.用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
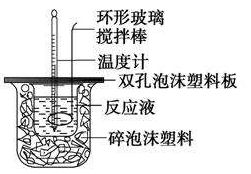
a.实验所用的酸和碱溶液应当用稀溶液(0.1~0.5 mol·L-1),否则会造成较大误差。
c.使用同一支温度计分别先后测量酸、碱及混合液的最高温度,测完一种溶液后须用水冲洗干净并用滤纸擦干再测另一种溶液的温度。
这个知识点是不是有点多,没关系,我们只要将一个复杂的问题拆分成几个简单的问题,再逐一解决,那么复杂的问题也将变得轻松。马上便是新年了,彭老师先在这里祝福大家新年快乐,“猪”事顺利了。