AG平台真人 真人AG 平台官网AG平台真人 真人AG 平台官网只有当反应物分子碰撞,并且具有足够的能量(被称为活化能)以及正确的空间取向,反应才能发生。
在任何给定的时间,反应物分子在容器中以不同的速度和各个方向移动。当它们的行进路线交汇时,就会发生碰撞。这些碰撞可能会导致化学反应,也可能不会,具体取决于两个其他的条件:活化能阈值和碰撞的相对取向。
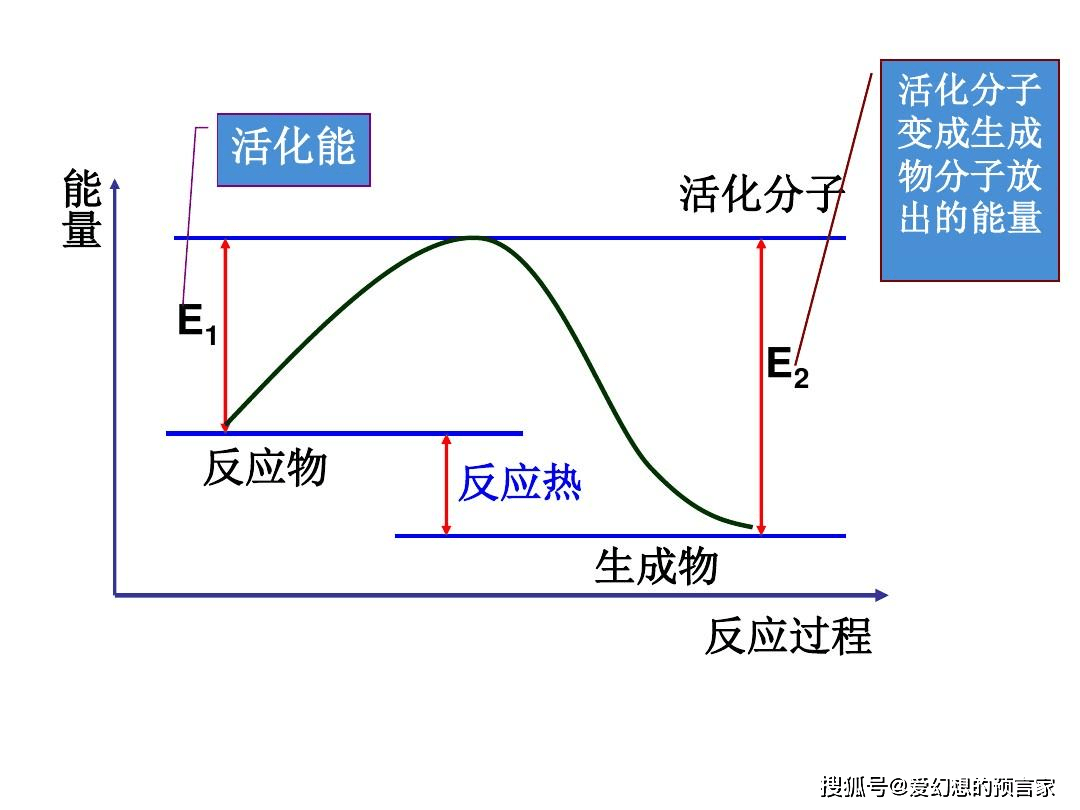
活化能是活化分子必须具备的最小能量,以便使反应继续进行,是一个反应能否发生的关键因素。活化能的来源是分子碰撞的动能。如果碰撞的能量足够高,足以超过活化能阈值,反应物分子就可以克服原有的化学键的阻力,形成新的化学键,从而生成产物分子。如果碰撞的能量低于活化能阈值,尽管反应物分子碰撞了,但反应并不会发生。
这里插一个小点:活化能值决定了反应发生的速率。一般而言,更高的活化能意味着较慢的反应速率,因为需要更多的分子具有足够高的动能来发生反应。
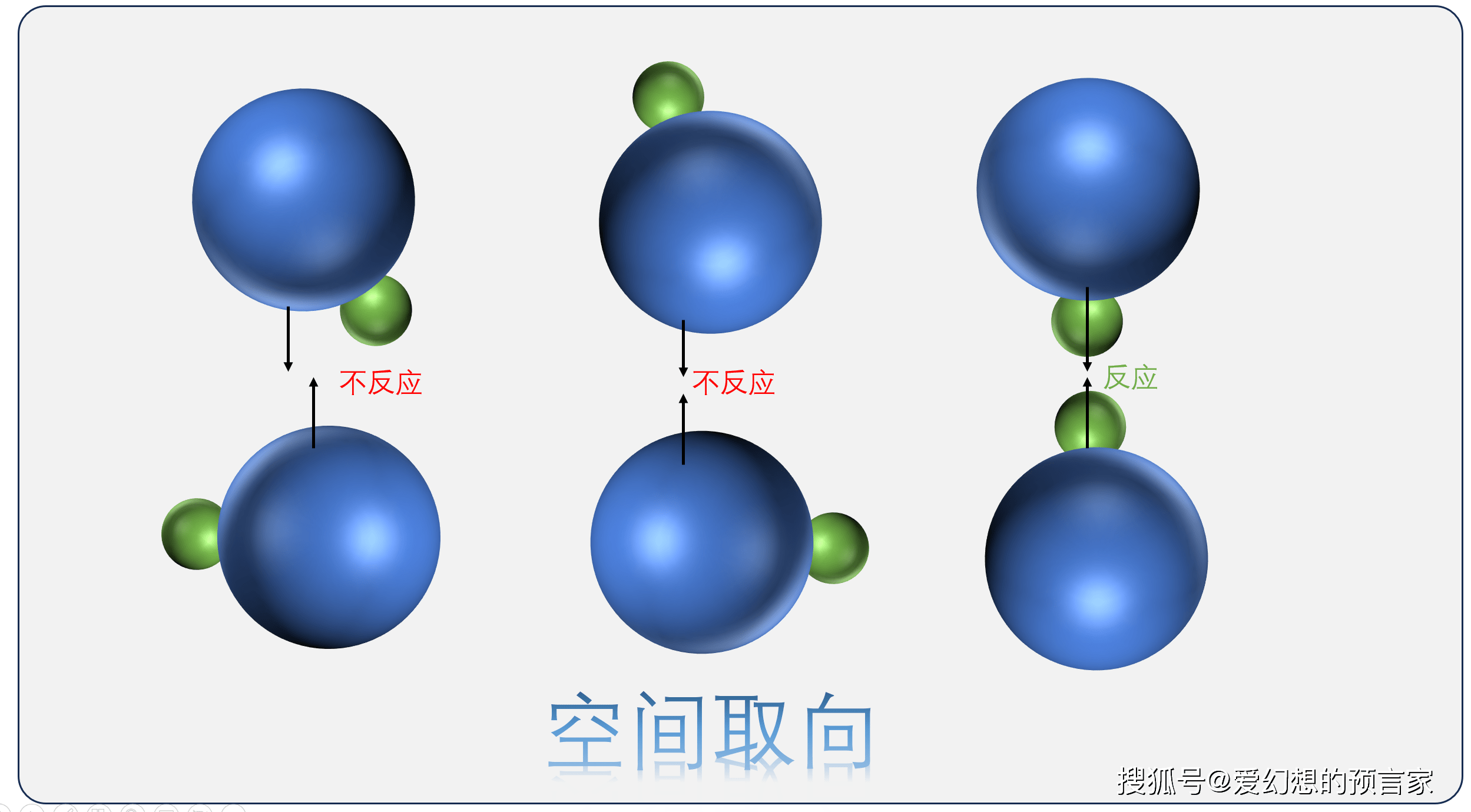
这是另一个决定化学反应能否发生的关键因素。自由分子碰撞的随机性导致了碰撞发生的方式多种多样。但是,只有当反应物分子以恰当的方式和角度碰撞,才能达到形成新化学键和断裂旧化学键的条件。如果碰撞的方向或角度不正确,即使分子具有足够的活化能,反应也不会发生。
碰撞理论也解释了为什么一些物理因素(如浓度、压力、温度和催化剂)可以影响反应速率。这是因为所有这些因素都以某种方式影响了碰撞的可能性、碰撞能量的分布或反应物分子的取向,从而改变了有效碰撞(即能够导致反应的碰撞)的频率。
增加反应物的浓度可以增加单位体积内分子的数量,从而增加它们碰撞的频率,这会增加有效碰撞的机会,因此反应速率提高。增加温度则会增加分子动能的平均值,使更多的分子有可能越过活化能阈值,从而增加了有效碰撞的频率,因此反应速率提高。催化剂则通过提供一个降低活化能的新反应路径,使更多的分子可以发生有效碰撞,同样会提高反应速率。
压力对反应速率的影响则依赖于反应的分子数量变化。如果反应的产物等于或少于反应物,则增加压力会增加反应速率,因为分子之间更容易碰撞。而反之,如果反应的产物多于反应物,则增加压力时反应速率会下降。返回搜狐,查看更多