肝纤维化是在各种慢性损肝因素的作用下,损伤与修复过程中细胞外基质( extracellular matrix , ECM )的合成和降解不平衡,最终导致 ECM 在肝内过度沉积所致。肝纤维化是各种慢性肝病的共同病理基础 [1] 。肝硬化和终末期肝病已是全球健康负担和致死的主要原因之一 [2] 。如何有效防治及逆转肝纤维化一直是当今世界医学热点和难题,但迄今还没有理想的抗肝纤维化生物或化学药物,中医药治疗肝纤维化有较好的疗效,近年来备受关注 [3] 。 c-Jun 氨基末端激酶( c-Jun N-terminal kinase , JNK )通路参与调节细胞增殖、凋亡、自噬和炎症等多种细胞过程,与肝纤维化密切相关 [4-5] 。课题组长期采用扶肝化纤汤治疗肝纤维化并取得较好临床疗效,前期研究发现该方可能通过调控 p-JNK 、细胞外调节蛋白激酶( extracellular regulated protein kinases , ERK )、 p38 蛋白表达,抑制有丝分裂原活化蛋白激酶( mitogen-activated protein kinase , MAPK )信号通路延缓肝纤维化大鼠的肝脏病理进展 [6] ,但尚未对扶肝化纤汤调节 MAPK 信号通路是否介导了肝星状细胞( hepatic stellate cells , HSC )的活化增殖过程进行探讨。因此,本研究以 HSC-T6 细胞为AG平台真人 真人AG 平台官网对象,加入 5 ng/mL 转化生长因子 -β1 ( transforming growth factor-β1 , TGF-β1 )诱导建立体外肝纤维化模型,探究扶肝化纤汤含药血清对 HSC-T6 细胞活化增殖、 JNK 信号通路和炎症因子白细胞介素 -1β ( interleukin-1β , IL-1β )、 IL-6 、肿瘤坏死因子 - α ( tumor necrosis factor- α , TNF- α )的影响,为进一步开发和临床应用提供基础。
清洁级雄性 SD 大鼠 40 只,体质量( 200 ± 20 ) g , 购自长沙市天勤生物技术有限公司,动物许可证编号 SCXK (湘) 2019-0014 。动物饲养于贵州中医药大学甲秀校区动物实验中心,自然采光,通风,室温 18 ~ 20 ℃,自由进食饮水。动物实验经贵州中医药大学第二附属伦理委员会批准(批准号 20210035 )。
按处方配比称取药材,加水浸泡 1 h ,用 10 倍量水煎煮 2 次(第 1 次多加 2 倍量水),每次 1 h ,滤过,滤液浓缩至 1 g/mL 的药液。扶肝化纤汤中黄芪、柴胡为君药,其主要药效成分为黄芪甲苷和柴胡皂苷。经高效液相色谱测定,黄芪甲苷、毛蕊异黄酮葡萄糖苷、柴胡皂苷 A 的质量浓度分别为 0.093 、 0.038 、 0.029 mg/mL 。
据动物与成人每千克体质量剂量折算系数 6.25 计算大鼠中药临床等效量 [7] ,即扶肝化纤汤给药剂量为 18.75 g/kg 。大鼠随机分为正常组和给药组,给药组 ig 药物,正常组 ig 等体积生理盐水, 1 次 /d ,连续 1 周。给药结束后,大鼠麻醉,腹主动脉采血, 4 ℃静置分离 2 h , 4 ℃、 3000 r/min 离心 10 min ,取上清,合并同组血清。将血清密封用隔水薄膜包装后,置于 56 ℃恒温水浴锅内灭活 30 min ,再经 0.22 μm 滤膜滤过除菌,于 − 20 ℃保存备用。
HSC-T6 细胞用含 10% 胎牛血清和 1% 青霉素 - 链霉素的 DMEM 培养基,于 37 ℃、 5% CO2 、饱和湿度的细胞培养箱中培养, 2 ~ 3 d 更换细胞培养液,观察细胞贴壁情况。设置对照组(含 15% 正常血清的培养基)、模型组(含 15% 正常血清的培养基)、扶肝化纤汤含药血清组(含 15% 扶肝化纤汤含药血清的培养基)和 JNK 抑制剂组(含 15% 正常血清和 20 μmol/L SP600125 的培养基),模型组和各给药组加入 TGF-β1 ( 5 ng/mL ),各给药组加入药物干预 24 h 后进行相关检测。
取 3 ~ 5 代 HSC-T6 细胞,以 2 × 104/ 孔接种于 96 孔板中,设置对照组、模型组和含药血清( 5% 、 8% 、 10% 、 15% 、 20% )组,对照组加入 200 μL 含 10% 胎牛血清的培养基,其余组加入 1 μL TGF-β1 (终质量浓度为 5 ng/mL ),含药血清组分别加入 190 μL 不同体积分数的含药血清培养 24 h ,酶标仪测定 450 nm 处的吸光值( A )值,计算细胞存活率。
按“ 2.3 ”项下方法处理细胞,收集细胞, PBS 洗涤 2 次,加入裂解液于冰上裂解 30 min ,提取细胞总蛋白, BCA 法测定总蛋白浓度,蛋白样品经十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳,转至 PVDF 膜,封闭后,加入一抗( 1∶500 ), 4 ℃孵育过夜; TBST 洗膜 3 次,加入二抗( 1∶5000 ),室温孵育 2 h , TBST 洗膜, ECL 化学发光法显色,于凝胶成像仪中观察并拍照。
24 孔培养板中放入制备好的盖玻片,细胞接种至盖玻片上进行培养,按“ 2.3 ”项下方法处理细胞,加入一抗、二抗孵育,含抗荧光淬灭剂封片,激光扫描聚焦显微镜下采集图像。
采用 SPSS 22.0 软件对数据进行统计学分析,计量资料采用 Shapiro-Wilk ( S-W )法进行正态分布检验,数据以 表示。多组间差异采用单因素方差分析,满足正态分布且方差齐的数据用 Bonferroni 检验进行组间两两比较,方差不齐先用 Welch 检验进行总体均值比较,再用 Dunnett’sT3 检验进行两两比较。
3.1 扶肝化纤汤含药血清对TGF-β1诱导的HSC-T6细胞形态的影响
如图 1 所示,对照组细胞伸展生长,透光度好,呈扁圆形。模型组细胞变长,胞体变大,胞质内折光颗粒减少,部分细胞融合成片状,符合激活型 HSC 表现;扶肝化纤汤含药血清组和 JNK 抑制剂组均可抑制 HSC-T6 细胞生长,细胞趋向表现为静止型 HSC 。

3.2 扶肝化纤汤含药血清对TGF-β1诱导的HSC-T6细胞增殖的影响
如表 1 所示,与模AG平台真人 真人AG 平台官网型组比较, 5% 、 8% 、 10% 、 15% 、 20% 的扶肝化纤汤含药血清对 TGF- b 1 诱导的 HSC-T6 细胞增殖均有抑制作用( P < 0.05 ),以 15% 、 20% 含药血清抑制作用最佳,两组之间无显著性差异,选择 15% 含药血清进行后续实验。
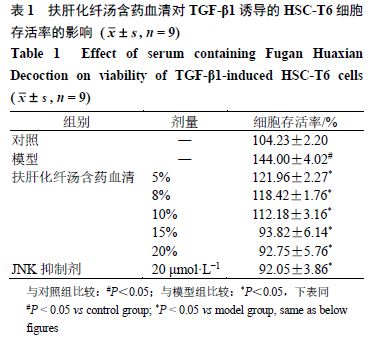
3.3 扶肝化纤汤含药血清对TGF-β1诱导的HSC-T6细胞上清液中IL-1β、IL-6和TNF-α水平的影响
如表 2 所示,与对照组比较,模型组细胞上清液中 IL-1β 、 IL-6 、 TNF-α 水平均明显升高( P < 0.05 );与模型组比较,各给药组 IL-1β 、 IL-6 、 TNF-α 水平均显著降低( P < 0.05 )。
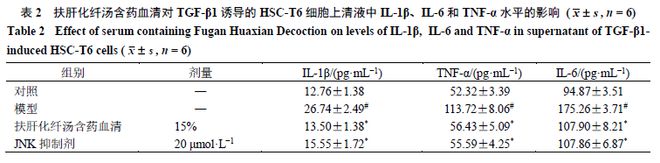
3.4 扶肝化纤汤含药血清对TGF-β1诱导的HSC-T6细胞p-JNK和α-SMA蛋白表达的影响
如图 2 和表 3 所示,与对照组比较,模型组 p-JNK 、 α-SMA 蛋白表达水平明显升高( P < 0.05 );与模型组比较,各给药组 p-JNK 、 α-SMA 蛋白表达水平明显降低( P < 0.05 )。
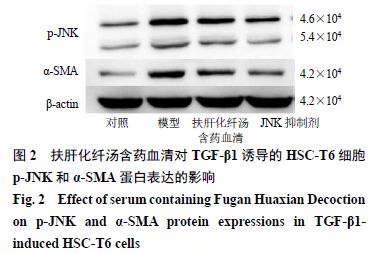
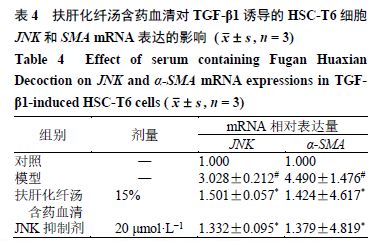
如表 4 所示,与对照组比较,模型组 JNK 、 α-SMA mRNA 表达水平明显升高( P < 0.05 );与模型组比较,各给药组 JNK 、 α-SMA mRNA 表达水平明显降低( P < 0.05 )。
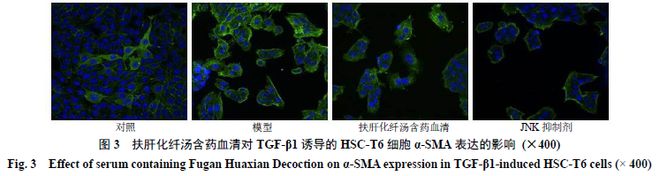
如图 3 所示, TGF-β1 诱导后的 HSC-T6 细胞呈 活化态, α-SMA 在细胞核内表达。与对AG平台真人 真人AG 平台官网照组比较,模型组 α-SMA 绿色荧光数量增多;与模型组比较,各给药组 α-SMA 绿色荧光数量减少。
JNK 激活参与了炎症损伤、伤口愈合等过程中各种细胞的应激反应,并参与毒性、代谢性、自身免疫性和肿瘤性等肝病损伤的调节, JNK 信号激活可以促使静默的 HSC 转化为肌成纤维细胞 [8] 。研究显示在肝纤维化动物模型中 JNK 表达明显升高,且主要富集在肌成纤维细胞中,拮抗 JNK 表达后可以缓解肝纤维化动物模型的肝脏纤维化程度 [9] ,细胞实验中还发现 JNK 抑制剂阻止了 TGF-β 、血小板衍生生长因子等细胞因子诱导的小鼠 HSC 活化。
诸多研究证实了 JNK 信号通路与肝纤维化的密切关系, JNK 主要位于细胞质,在细胞因子 IL-1β 、 TNF-α 等刺激下发生核转位,进入细胞核级联激活相应核内转录因子而被磷酸化激活,促进 c-Jun 及其下游基因转录和蛋白表达,进一步释放致炎细胞因子,放大炎症损伤,参与肝纤维化的发生、发展,在肝脏疾病发病中有关键作用 [9] 。 IL-1 对 HSC 活化中具有关键作用,并调节肝损伤引起的纤维化的发展,已经确定了 IL-1 家族表达与 肝纤维化严重程度呈正相关 [10] 。 IL-6 主要由巨噬细胞和 Th2 细胞产生,其与 TNF-α 作为促炎介质,高表达水平可导致肝细胞坏死,参与肝损伤期间的炎症过程 [11] 。 Li 等 [12] 研究发现川陈皮素通过靶向 JNK 信号通路诱导肝细胞凋亡来保护急性肝损伤。 Cubero 等 [13] 研究发现 Myostatin 通过 JNK 信号激活肝星状细胞的成纤维表型发生增殖活化,其 JNK 蛋白直接激活 HSC ,促进 I 型胶原纤维形成,使 α-SMA 表达增多。 González-Vázquez 等 [14] 研究发现 JNK 信号通路抑制剂可以有效抑制肝星状细胞的增殖活化从而达到抗肝纤维化的作用。这些研究表明抑制 JNK 信号通路可能实现抗肝纤维化作用。
肝纤维化与中医学“肝癖”“肝着”“积聚”等病内涵相似,中医认为肝脾密切相关,生理上,肝主疏泄,脾主运化;肝藏血,脾统血。脾为气血生化之源,脾得肝之疏泄,则升降协调,运化健旺,气血生化有源,肝血充足则肝有所藏,肝体得以濡养,才会肝气冲和条达,疏泄正常。即所谓“土得木而达”“木赖土以培之”“培土荣木”。《难经 · 第七十七难》中言:“肝病当传之于脾,故先实其脾气”,仲景承其思想,在《金匮要略》里有云:“见肝之病,知肝传脾,当先实脾, …… 故实脾,则肝自愈。此治肝补脾之要妙也”。叶天士曰“补脾必以疏肝,疏肝即以补脾也”。因此在慢性肝病中,强调“从脾论治、培土荣木” [16] 。扶肝化纤汤由黄芪、当归、白芍、鳖甲、丹参、白术、枳实、黄精、柴胡、绞股蓝、炙甘草、三七粉组成,临床用于肝纤维化治疗效果明显,前期实验表明 [6,16-17] , 扶肝化纤汤可保护肝细胞、改善肝功能、控制肝纤维化进展。其机制可能是通过影响 TGF-β1/Smad 信号转导通路,抑制 TGF-β1 诱导的 HSC 的活化增殖发挥抗肝纤维化作用。本次实验再次验证扶肝化纤汤含药血清可抑制 HSC 的活化增殖,能够显著下调活化 HSC 的 JNK 、 α-SMA mRNA 表达,降低了活化 HSC 的 p-JNK 和 α-SMA 蛋白水平,抑制炎症细胞因子 IL-1β 、 IL-6 、 TNF-α 的释放。通过调控 JNK 信号通路抑制 HSC 活化增殖,减少炎症介质分泌,继而减少 ECM 的合成,可能是扶肝化纤汤抗肝纤维化的可能机制之一。但肝纤维化病因病机复杂,介导的细胞信号通路众多,而中药复方制剂往往又具有多层面、多靶点、多途径的作用特性,因此,扶肝化纤汤抗纤维化的作用机制值得进一步研究探讨。
来 源:肖政华,李婷婷,石以石则,杨庆万,李珊珊.基于JNK信号通路探讨扶肝化纤汤对肝星状细胞活化增殖的影响 [J]. 中草药, 2023, 54(16):5283-5288.
【福利时刻】购买细胞及相关实验,扫码或加微信(1278317307)入群。

本公众号已与浙江慧通测评动物实验中心搭建紧密的合作关系:该动物中心已获得动物使用许可并在建动物行为学实验中心,如您需要含药血清制备-成分分析、灌胃给药、造模、药理、毒理以及相关实验技术支持,欢迎联系我们(1278317307)!AG真人 AG平台AG真人 AG平台AG真人 AG平台