提起碳氢键大家都不陌生,它是有机化学中最基本的化学键,几乎所有的有机化合物都含有碳氢键。然而,碳氢键的键能非常高,碳和氢的电负性又十分接近,因此碳氢键的极性很小,要想在温和的条件下实现碳氢活化颇具挑战。最近几十年,过渡金属催化的碳氢活化/官能团化已成为有机合成化学中强有力的工具。近日,美国如何在天然产物全合成中利用碳氢活化策略来构建碳碳键,并系统比较和分析了传统方法与碳氢活化方法完成的全合成,突出了碳氢活化是一种更高效的逆合成分析策略。最后,作者指出了现有碳氢活化方法的局限性,并展望了如何发展下一代碳氢活化方法来进一步提高全合成效率。
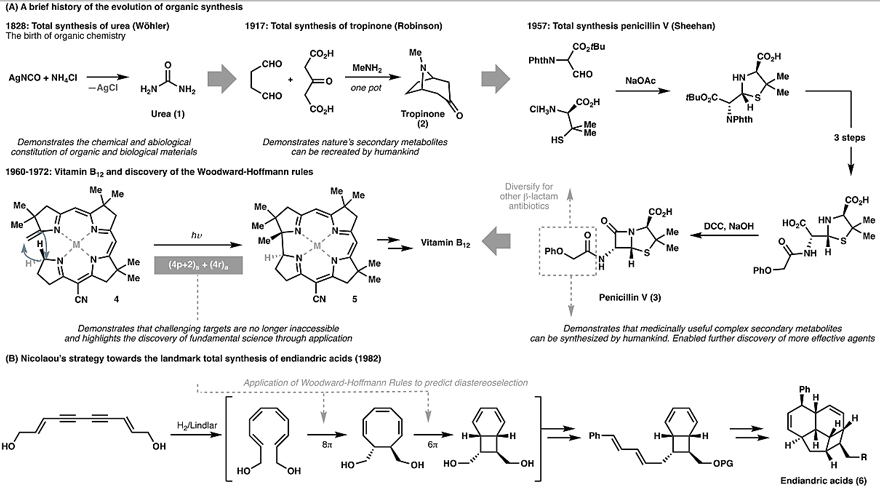
众所周知,有机化学的发展与天然产物全合成密不可分,最早可追溯到Wöhler的尿素(1)全合成(图1A)。在随后的150年里,化学家逐渐实现了复杂天然产物的全合成:从经典的Robinson托品酮仿生全合成(2)到Sheehan的青霉素(3)这一最早发现的抗生素的全合成,从Woodward的维生素B12全合成及其中分子轨道对称守恒原理的提出到Nicolaou利用该原理实现endiandric acids(6)的全合成(图1B)。全合成无时无刻不在推动着有机合成的发展。
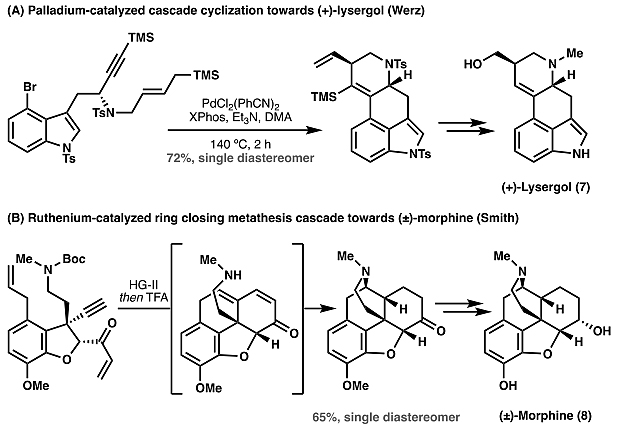
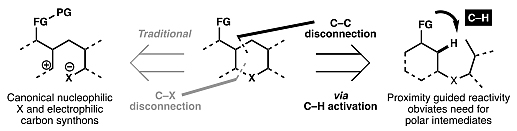
在过去的30年里,过渡金属催化的反应(如交叉偶联和烯烃复分解)也得到了巨大的发展,并成功用于如(+)-lysergol(7)和(8)的全合成(图2)。而与传统的金属催化反应相比,碳氢活化反应无需额外的偶联基团(如硼酸)或是反应官能团(如碳碳双键),并且潜在地可引入各类官能团,构筑碳碳键或是碳杂原子键。这一特性使得碳氢活化反应能够潜在对于目标分子进行核心结构导向的逆合成分析 (即核心结构无需重新构建)。然而,与经典地交叉偶联和复分解反应相比,碳氢活化反应却很少应用于全合成中。为此,本综述概述了如何通过过渡金属催化的碳氢活化在全合成过程中构建碳碳键,并且阐述了碳氢活化策略的优势。
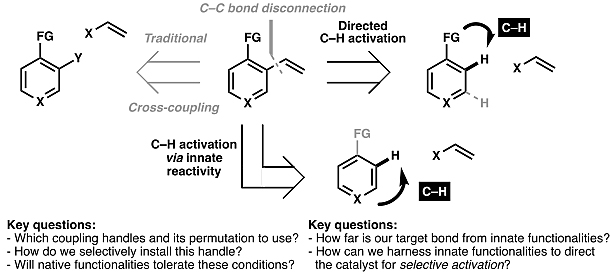
尽管过渡金属催化的交叉偶联反应已得到了广泛的应用,但是它们通常需要将底物进行预先官能团化,以便与过渡金属催化剂结合并生成金属有机中间体。相比之下,C(sp2)–H键活化则无需预先官能团化,便可直接生成所需的金属–C(sp2)物种。目前,AG真人 AG平台在全合成中主要有两种通用的策略来实现位点选择性碳氢活化以构建C(sp2)–C键(图3)。第一种是利用底物固有Lewis碱官能团,如醇、胺、酸,通过环金属化导向至所需的C(sp2)–H键;第二种则是利用芳香杂环底物固有的反应性,但是该方法的区域选择性较差,底物范围较窄。
2005年,Fürstner等人首次报道了dictyodendrin B的全合成,他们利用6π-电环化来构建咔唑骨架中的芳基,最终以13步、8%的总收率实现了dictyodendrin B(9)的全合成(图4)。2015年,Gaunt等人通过C(sp2)–H键官能团化来引入dictyodendrin B的所有侧基,最终以13步实现了dictyodendrin B(9)的合成(图5)。尽管收率不及Fürstner报道的方法(9% vs 17%),但是该方法操作简单,且能以克级规模制备,相比传统有机合成方法,利用碳氢活化方法实现了核心结构导向的全合成。类似地,Yamaguchi等人通过铑催化的C–H键芳基化,改进了lamellarins的合成路线,最终以八步实现了lamellarin C和I(27和28)的全合成(图6),这也是迄今为止该类天然产物全合成的最短合成路线. Dictyodendrin B(
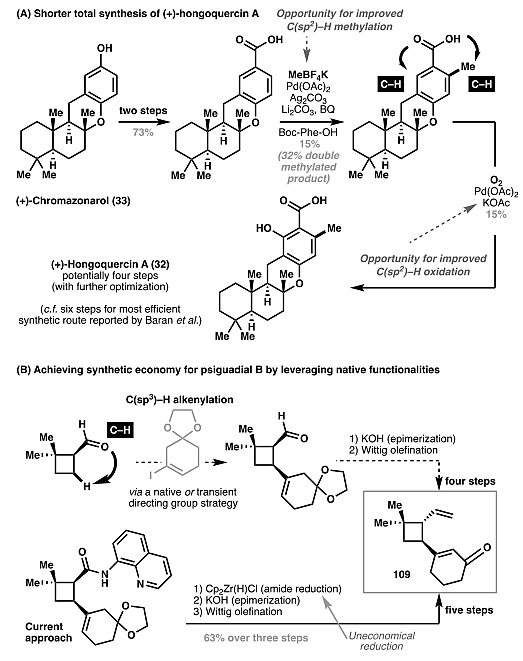
)–C键。2011年,余金权与Baran课题组合作,从(+)-chromazonarol(33)出发,通过钯催化的羧基导向的C(sp2)–H键活化选择性地安装羟基和甲基(图7A),最终以6步实现了(+)-hongoquercin A(32)的全合成。此外,他们还通过不同C(sp2)–H键官能团化方法实现了七种hongoquercin A类似物的合成(图7B),进一步证明了该方法的多样化。值得一提的是,这种逆合成方法还可以扩展到芳族化合物的C(sp2)–H键烯基化,(+)-lithospermic酸(36,图8、9)的全合成。图7. (+)-Hongoquercin A(
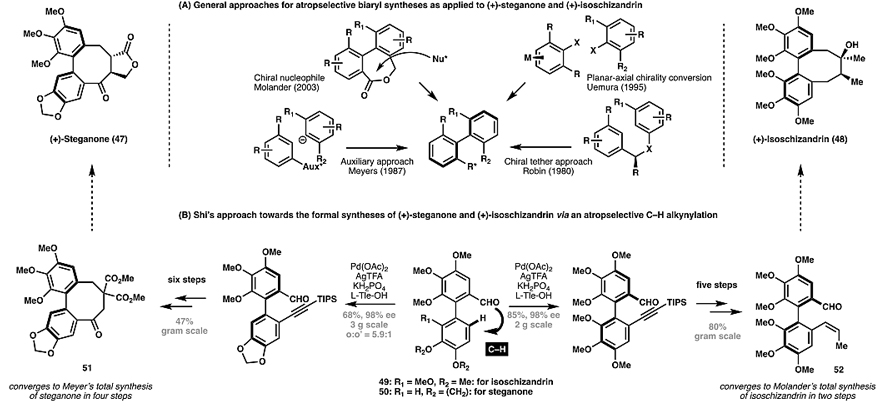
此外,过渡金属催化的碳氢活化反应还可以通过瞬息导向基策略来构筑轴手性产物,为传统联芳基轴手性的构筑提供了新的思路(图10A)。2018年,史炳锋等人通过瞬息导向基策略的发展的C(sp
)–H键炔基化来构建轴手性(图10B)。从联芳基醛49和50出发,高效地合成了(+)-steganone(47)和(+)-isoschizandrin(48)的前体51和52,该方法不仅对映选择性好,而且以高度区域选择性在位阻最小的邻位C–H键上进行C(sp2)–H键炔基化,且能以克级规模制备。图10. (+)-Steganone(
)–H键相比,过渡金属催化的C(sp3)–H键活化过程更具挑战性,这是因为脂肪族C–H键的键焓要比C(sp2)–H键的键焓高。另外,由于脂肪族底物固有的柔韧性,使得环金属化配合物的形成会导致更大的熵损失,同时会伴有竞争性的β–H消除副反应。为了克服C(sp3)–H键活化过程所固有的热力学障碍,需要将金属催化剂置于目标C(sp3)–H键附近,以最大程度地减少熵损失。迄今为止,最可靠的方法是使用Lewis碱作为导向基,并且大多数情况下会生成动力学上更有利的五元环金属化中间体。最近,余金权课题组通过双齿导向基(如瞬息导向基策略)的设计可以活化各种脂肪胺底物的γ-位和δ-位。此外,使用刚性的双齿导向基可能不利于张力更大的5,5-金属杂双环,而是有利于张力较小的6,5-双环中间体的生成(图11)。图11. 影响位点选择性C(sp
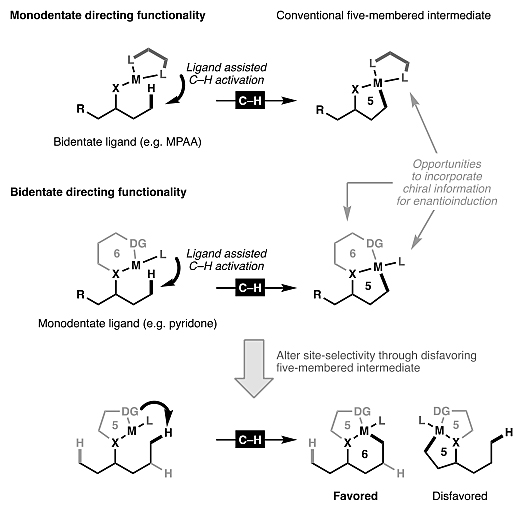
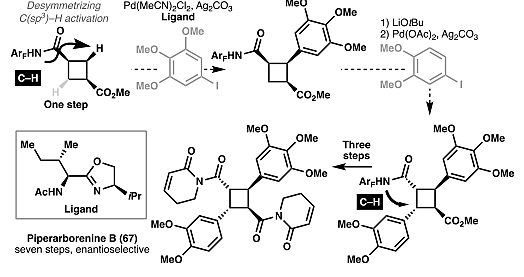
图13. Piperarborenine B、piperarborenine D及pipercyclobutanamide A的全合成(Baran等人)。图片来源:
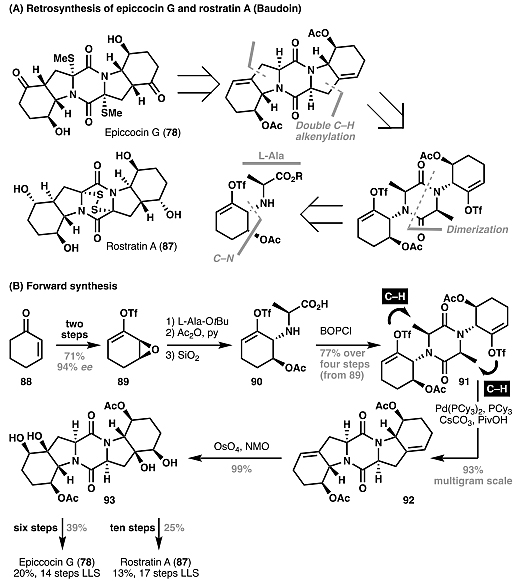
)–X键制备而成。为了避免化学选择性问题,通常需要进行额外的氧化还原或者保护基操作(图15)。相比之下,过渡金属催化的碳氢活化过程则可以避免这些问题。例如Baudoin等人通过双重C(sp3)–H键烯基化实现了(–)-epiccocin G(78)以及(–)-rostratin A(87)的全合成(图16)。图15. 传统合成方法与C–H键活化在饱和杂环合成中的区别。图片来源:
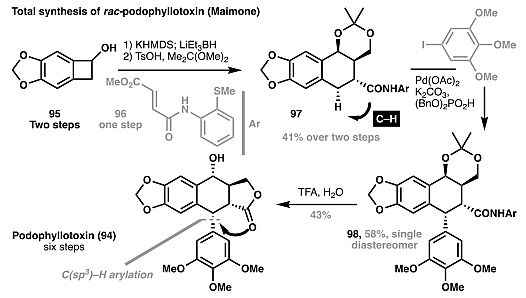
此外,脂肪族环状底物的官能化也可以扩展到非张力环体系,尽管由于开链碳氢键的键焓较高而更具挑战性。尽管如此,不少化学家仍利用该策略来合成天然产物,例如Maimone等人通过后期导向的C(sp
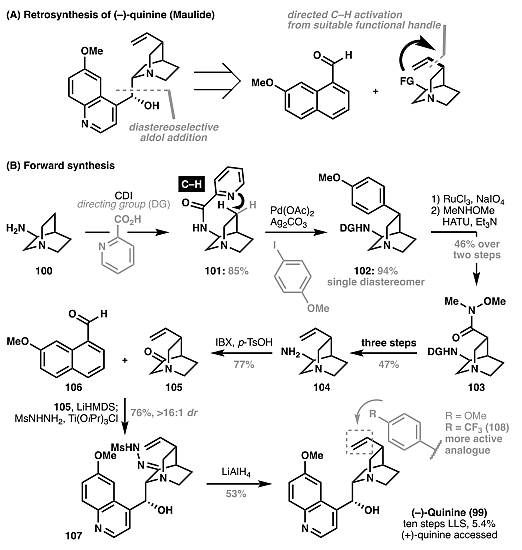
)–H键芳基化,以六步实现了podophyllotoxin(94)的全合成(图17),而传统的逆合成方法则涉及到脂肪族环的开环且合成步骤繁琐(24步)。2018年,Maulide等人以C(sp3)–H芳基化为关键步,以10步完成对奎宁(99)的全合成(图18)。图17. Podophyllotoxin (
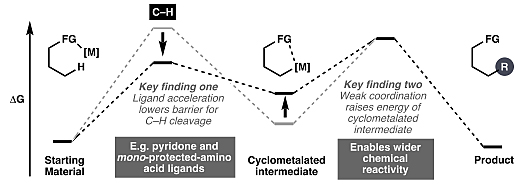
尽管通过C–H键活化策略可以实现一些天然产物的全合成,但是该领域面临的一个长期挑战是碳氢活化能实现的官能团化范围通常很有限。在过去的十年里,化学家们发现解决该问题的关键在于配体的引入,以及利用弱配位导向基,从而使环金属化中间体更具反应性,以适合于各种碳碳键或碳杂原子键的构筑(图19)。最近,余金权课题组发展了一系列配体辅助的不对称C(sp
)–H键的交叉偶联反应,例如乙烯基硼酸酯与三氟甲磺酰胺导向的不对称C(sp3)–H键烯基化反应(图20A)。AG真人 AG平台如果该方法能实用于奎宁的含氮双环结构的线步便可实现对其的不对称全合成,比Maulide先前报道的方法总步数少4步(图20B)。图19. 实现C–H键活化转化的关键因素。图片来源:
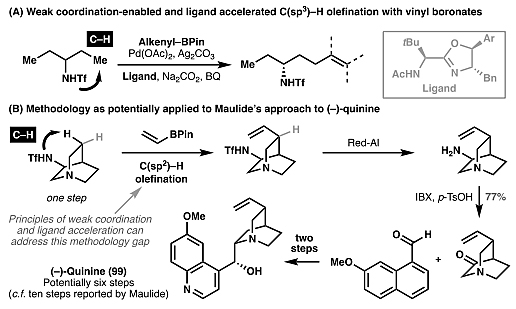
)–H键活化及其在奎宁全合成的潜在应用。图片来源:Angew. Chem. Int. Ed.此外,全合成中大多数的碳氢活化反应均依赖于大型且强配位的导向基,以便将过渡金属催化剂结合在目标碳氢键上。然而,这些导向基(如酰胺)大多数情况下需要单独安装(图21),并难以脱除,因此如何发展以底物自身官能团作为导向基变得极为重要。目前,各类羰基官能团(如酸、酰胺、AG平台真人 真人AG 平台官网酮)已被成功地作为碳氢活化的导向基。对于胺、醛和酮底物而言,可逆亚胺的形成使得发展瞬态导向基策略成为可能,从而避免了额外导向基的安装和脱除。例如:从(+)-chromazonarol(
32,图22A),而无需额外引入导向基;此外,在psiguadial B(77)的全合成过程中,利用瞬息导向基策略,潜在地能够以更原子经济性的方法合成官能化的环丁烷109(图22B)。图21. 自身官能团导向的碳氢活化策略。图片来源:
最后,作者讨论了碳氢活化在不对称合成中的应用。先前的研究表明通过额外配体辅助,AG平台真人 真人AG 平台官网碳氢活化过程能够使C(sp
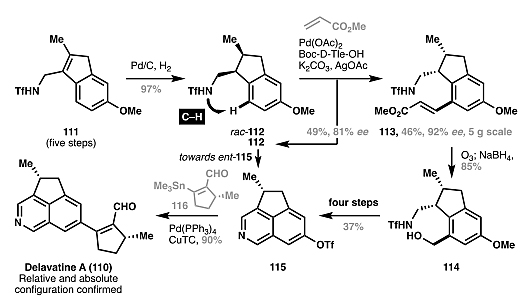
)中心去对称化,比如最近的研究表明利用手性配体能够实现环丁烷的不对称官能团化。若利用该策略,潜在地能以6步实现了piperarborenine B(67)的对映选择性全合成(图23)。此外,张卫东、李昂、AG平台真人 真人AG 平台官网沈云亨等人也通过类似的去对称化方法实现了delavatine A(110)的全合成(图24)。图23. 不对称碳氢活化反应在piperarborenine B全合成中的潜在应用。图片来源:
Nelson Y. S. Lam, Kevin Wu, Jin-Quan Yu